ערכת TIANScriptⅡ RT
מאפיינים
■ פעילות ויעילות אנזים גבוהה: פעילות טרנסקריפטאז הפוכה גבוהה ותאימות טובה בניסויים הבאים.
■ טווח מצעים רחב: מתאים לכל RNA, במיוחד תבניות RNA עם מבנים משניים מורכבים.
■ אורך RT ארוך: הסינתזה של הגדיל הראשון של cDNA יכולה להגיע ל -12 קילוגרם.
■ פעולה פשוטה: פשוט הוסף את הרכיבים הנדרשים בשלב אחד מבלי להוסיף שום ריאגנט במהלך הפעולה.
יישומים
■ סינתזה של גדיל cDNA הראשון.
■ בניית ספריית cDNA.
■ RT-PCR שלב אחד.
■ ניתוח RACE.
ניתן להתאים את כל המוצרים עבור ODM/OEM. לפרטים,אנא לחץ על שירות מותאם אישית (ODM/OEM)
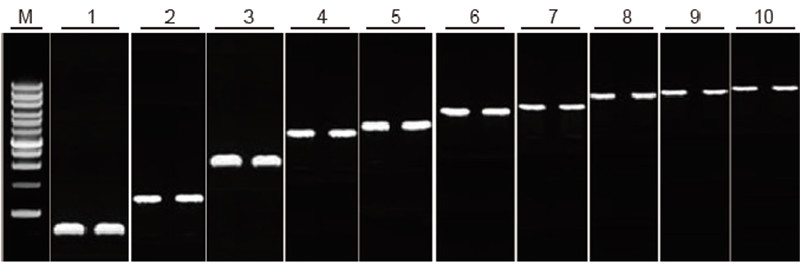 |
יכולת שעתוק הפוכה של ערכת TIANScript II RT לשברי אורך שונים שיטה: שעתוק הפוך: עיין במדריך ההוראות של ערכת TIANScript II RT. תוצאות: תמונת הג'ל מציגה את תוצאות ההגברה של 10 גני מטרה באורכים שונים לאחר שעתוק הפוך של 1 מיקרוגרם של ה- RNA הכולל. 2 μl של מוצרי שעתוק הפוך נטענו לנתיב. מערכת הגברה (PCR): 20 μl; עומס לדוגמא: 5 μl; סמן: D15000+1 kb סולם DNA; ריכוז ג'ל: 1%; תנאי אלקטרופורזה: 6 V/ס"מ, 20 דקות תרשים של כל נתיב: M: DNA Marker; 1: אורך המוצר: 120 bp; 2: אורך המוצר: 1 קילוגרם; 3: אורך המוצר: 2.5 קילוגרם; 4: אורך המוצר: 3.2 kb; 5: מוצר אורך: 4.6 קילו־בייט; 6: אורך המוצר: 6.8 קילוגרם; 7: אורך המוצר: 7.6 קילוגרם; 8: אורך המוצר: 8.9 kb; 9: אורך המוצר: 10 קילוגרם; 10: אורך המוצר: 12 kb; |
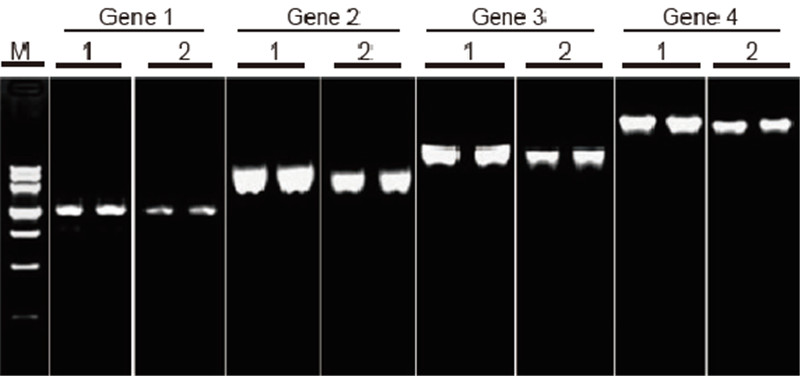 |
השוואת היעילות והספציפיות של ערכת TIANScript II RT ומוצרים מספקים אחרים בתעתיק הפוך של תבניות ארוכות חומרים: סך ה- RNA של תאים דבקים אנושיים. כמות התחלתית של RT-PCR: 2 μl מוצר שעתוק הפוך (50 ng/μl) שיטה: שעתוק הפוך: עיין במדריך ההוראות של ערכת TIANScript II RT. תוצאות: תמונת הג'ל מציגה את תוצאות ההגברה של 6 גני מטרה באורכים שונים לאחר שעתוק הפוך של RNA כולל של 1 מיקרוגרם של תאים דבקים אנושיים באמצעות M-MLV מהספק A ו- TIANGEN TIANScript II RT Kit. מערכת הגברה (PCR): 20 μl; עומס לדוגמא: 5 μl; סמן: DNA MarkerIII; ריכוז ג'ל: 1%; תנאי אלקטרופורזה: 6 V/ס"מ, 20 דקות. תרשים של כל נתיב: M: DNA Marker; 1: תוצאות הגברה של תמלול הפוך של cDNA באמצעות ערכת TIANScriptII RT; 2. תוצאות הגברה של תמלול הפוך של cDNA באמצעות מוצר רלוונטי מהספק א. אורך המוצר של גן 1 הוא 1.3 kb; אורך המוצר של גן 2 הוא 3.0kb; אורך המוצר של גן 3 הוא 5.0 קילוגרם; אורך המוצר של גן 4 הוא 7.5 קילוגרם. |
A-1 RNA מושפל
—— לטהר RNA באיכות גבוהה ללא זיהום. החומר שממנו מופק ה- RNA צריך להיות טרי ככל האפשר כדי למנוע פירוק RNA. לנתח את שלמות ה- RNA על ג'ל מפוגל לפני תגובת RT. לאחר מיצוי RNA, יש לאחסן אותו ב -100% פורממיד. אם משתמשים במעכב RNase, טמפרטורת החימום צריכה להיות <45 ° C, וה- pH צריך להיות נמוך מ -0.0, אחרת המעכב ישחרר את כל ה- RNase הקשור. יתר על כן, יש להוסיף מעכב RNase בתמיסות המכילות ≥ 0.8 מ"מ DTT.
A-2 RNA מכיל מעכבי תגובות שעתוק הפוך
מעכבי שעתוק הפוכים כוללים SDS, EDTA, גליצרול, נתרן פירופוספט, spermidine, פורממיד, מלח גואנידין וכו '. מערבבים את ה- RNA הבקרה עם הדגימה, ומשווים את התשואה עם תגובת ה- RNA הבקרה כדי לבדוק אם יש מעכב. לשטוף משקעים RNA עם 70% (v/v) אתנול להסרת מעכבים.
A-3 לא מספיק חישול של פריימרים המשמשים לסינתזה של הגדיל הראשון של cDNA
—— קבע כי טמפרטורת החישול מתאימה לפריימרים שבהם נעשה שימוש בניסוי. עבור hexamers אקראיים, מומלץ לשמור על הטמפרטורה ב 25 ° C למשך 10 דקות לפני שמגיעים לטמפרטורת התגובה. עבור פריימרים ספציפיים לגן (GSP), נסה GSP אחר, או עבור לאוליגו (dT) או להקסאמר אקראי.
A-4 כמות קטנה של RNA מתחיל
—— הגדל את כמות ה- RNA. עבור דגימות RNA פחות מ -50 ננוגרם, ניתן להשתמש ב- 0.1 מיקרוגרם עד 0.5 מיקרוגרם אצטיל BSA בסינתזת cDNA הגדילה הראשונה
A-5 רצף המטרה אינו מתבטא ברקמות המנותחות.
—— נסה רקמות אחרות.
תגובת PCR A-6 נכשלת
—— עבור RT-PCR דו-שלבי, תבנית ה- cDNA בשלב ה- PCR אינה יכולה לחרוג מ -1/5 מנפח התגובה.
A-1 חישול לא ספציפי של פריימרים ותבניות
—— סוף 3'-פריימרים לא צריך להכיל 2-3 dG או dC. השתמש בפריימרים ספציפיים לגן בסינתזת הגדיל הראשון במקום פריימרים אקראיים או אוליגו (dT). השתמש בטמפרטורת חישול גבוהה יותר במחזורים הראשונים ולאחר מכן בטמפרטורת חישול נמוכה יותר. השתמש בפולימראז Taq DNA בהתחלה חמה ל- PCR כדי לשפר את הספציפיות של התגובה.
A-2 עיצוב לקוי של פריימרים ספציפיים לגן
—— עקוב אחר אותם עקרונות לעיצוב פריימר הגברה.
A-3 RNA מזוהם ב- DNA גנומי
—— התייחסו ל- RNA עם DNase I. בדרגת PCR. הקימו תגובת שליטה ללא שעתוק הפוך כדי לזהות זיהום DNA.
A-4 יצירת דימר פריימר
—— עיצוב פריימרים ללא רצפים משלימים בקצה 3 '.
A-5 Mg גבוה מדי2+ ריכוז
—— אופטימיזציה של Mg2+ ריכוז עבור כל שילוב תבנית ופריימר
A-6 מזוהם ב- DNA זר
—— השתמש בטיפים עמידים בפני אירוסול ואנזימי UDG.
A-1 התוכן של המוצר הגדיל הראשון גבוה מדי
—— הפחית את כמות המוצר הגדיל הראשון בשלב תגובת ה- PCR המקובל.
A-2 כמות פריימר גבוהה מדי בתגובת PCR
—— הפחת את קלט הפריימר.
A-3 יותר מדי מחזורים
—— אופטימיזציה של תנאי תגובת ה- PCR והפחתת מספר מחזור ה- PCR.
A-4 טמפרטורת חישול נמוכה מדי
—— הגדלת טמפרטורת החישול כדי למנוע התחלה והרחבה לא ספציפיות.
A-5 הגברה לא ספציפית של שברי oligonucleotide הנוצרים על ידי פירוק DNase של ה- DNA —- לחלץ RNA באיכות גבוהה למניעת זיהום DNA.
RT-PCR הוא להפוך תמלול RNA ל- cDNA ולאחר מכן השתמש ב- cDNA המתועתק הפוך כתבנית לתגובת PCR כדי להגביר את שבר המטרה. בחר פריימרים אקראיים, Oligo dT ופריימרים ספציפיים לגן בהתאם לתנאים הספציפיים של הניסוי. כל הפריימרים לעיל ניתנים לשימוש עבור mRNA תא אקריוטי קצר ללא מבנה סיכת ראש.
פריימר אקראי: מתאים ל- RNA ארוך עם מבנה סיכת ראש, כמו גם לכל מיני RNA כגון rRNA, mRNA, tRNA וכו '. הם משמשים בעיקר לתגובת RT-PCR של תבנית בודדת.
Oligo dT: מתאים ל- RNA עם זנב PolyA (RNA פרוקריוטי, oligo dT rRNA ו- tRNA אין זנבות PolyA). מכיוון שאוליגו dT קשור לזנב PolyA, איכות דגימות ה- RNA נדרשת להיות גבוהה, ואפילו כמות קטנה של השפלה תפחית מאוד את כמות סינתזת cDNA באורך מלא.
פריימר ספציפי לגן: משלים לרצף התבניות, מתאים למצבים בהם רצף המטרה ידוע.
ישנן שתי דרכים:
1. שיטת התייחסות פנימית: בתיאוריה, cDNA הוא שברי DNA באורכים שונים, ולכן התוצאה של אלקטרופורזה היא מריחה. אם שפע ה- RNA נמוך, שום מוצר לא יופיע באלקטרופורזה, אך אין זה אומר שאף מוצר לא יוגבר על ידי PCR. באופן כללי, ניתן להשתמש בהתייחסות פנימית לאיתור cDNA. אם יש להפניה הפנימית תוצאות, ניתן להבטיח את איכות cDNA בעצם (במקרים אחדים, אם קטע גן המטרה ארוך מדי, יתכנו חריגים).
2. אם יש גן ידוע שמוגבר על ידי תבנית זו, ניתן לאמת אותו על ידי הפריימרים של הגן הזה. הגברת ההתייחסות הפנימית אינה אומרת בהכרח שאין בעיה עם cDNA. מכיוון שלפניה פנימית יש שפע גבוה ב- cDNA, קל להגברה. אם cDNA מתכלה באופן חלקי מסיבות שונות, מנקודת מבט של הסתברות, תוצאות PCR של גני מטרה בשפע נמוך יושפעו מאוד. למרות שההתייחסות הפנימית עדיין גבוהה בשפע, ההגברה כנראה לא תושפע.
פגיעה חלקית ב- RNA. לזהות את היושרה ולטהר את ה- RNA
תכולת ה- RNA של מינים שונים עשויה להיות שונה, אך באופן כללי, ה- RNA הכולל שחולץ צריך להכיל שתי להקות 28S ו- 18S ברורות באלקטרופורזה של ג'ל, והבהירות של הלהקה לשעבר צריכה להיות גבוהה פי שניים מזו של השנייה. להקת 5S מצביעה על כך שה- RNA הושפל, ובהירותו פרופורציונלית למידת ההתדרדרות. ההגברה המוצלחת של ההתייחסות הפנימית אינה אומרת שאין בעיה עם RNA, מכיוון שההתייחסות הפנימית נמצאת בשפע גבוה, ניתן להגביר את ה- RNA כל עוד ההתדרדרות לא חמורה. ה- OD260/OD280היחס בין RNA טהור הנמדד בספקטרופוטומטר צריך להיות בין 1.9 ל 2.1. כמות קטנה של טומאת חלבון ב- RNA תפחית את היחס. כל עוד הערך אינו נמוך מדי, ה- RT לא יושפע. הדבר החשוב ביותר עבור RT הוא תקינות ה- RNA.
הרחבתו של גן ההתייחסות הפנימי יכולה רק להצביע על כך ש- RT הצליח, אך הוא אינו קשור בהכרח לאיכותו של גדיל ה- cDNA. מכיוון ששברי ההתייחסות הפנימיים בדרך כלל קטנים בגודלם ובעלי הביטוי, קל יותר להצליח בתעתיק הפוך. עם זאת, הגודל והביטוי של גן המטרה משתנים מגן לגן. אי אפשר לשפוט את איכות ה- cDNA רק בהתייחסות פנימית במיוחד עבור שברי המטרה שאורכם יותר מ -2 kb.
לחלק מהדגימות יש מבנים משניים מורכבים, או שיש להם תוכן GC עשיר, או שהם יקרים עם שפע נמוך. במקרים אלה, יש לבחור טרנסקריפטאז הפוך מתאים בהתאם לגודל שבר המטרה והמדגם. עבור תבניות RNA עם תוכן GC גבוה ומבנה משני מורכב, קשה לפתוח את המבנה המשני בטמפרטורה נמוכה, או עם טרנסקריפטאז הפוך נפוץ. עבור תבניות אלה, ניתן לבחור Quant Reverse Transcriptase, מאחר וביצועי התעתיק ההפוך שלו הם ללא ספק טובים יותר מזה של טרנסקריפטאז הפוך מסדרת M-MLV, אשר יכול להפוך את התמלול של תבניות RNA שונות ביעילות ולתמלל את ה- RNA לגדיל הראשון של cDNA במידה המרבית. בעת שימוש בערכת טראנסקריפטאז כללית הפוכה, מערכת 20 μl יכולה להפוך באופן יעיל רק את התמלול של 1 מיקרוגרם של ה- RNA הכולל. אנא שימו לב ליכולת ה- RT המרבית של הערכה. אם התבנית מתווספת בעודף, שעתוק הפוך יעדיף את ה- RNA בשפע גבוה. לכן, עדיף לא לחרוג מהקיבולת המרבית של המערכת.
A-1 לקבוע אם RNA מתכלה בצורה חמורה ואם RT מצליח
באופן כללי, הסיבה לכשל בהגברת הפניה הפנימית נגרמת לעיתים קרובות מהשפלה רצינית של ה- RNA. סיבה אפשרית נוספת היא כשל בתעתיק הפוך. לא ניתן להשתמש בהתייחסות פנימית כתקן כדי לשפוט את איכותו של גדיל יחיד cDNA, אך ניתן להשתמש בו כתקן כדי לשפוט אם שעתוק הפוך מוצלח אם אין בעיה של איכות ה- RNA. הדבר החשוב ביותר בתהליך השעתוק ההפוך הוא שמירה על טמפרטורה קבועה ומערכת תגובה קבועה על מנת לשפר את יעילות התגובה.
A-2 קבע אם הפריימרים להגברת גני הפניה פנימיים אמינים ואם יש בעיות עם ריאגנטים המשמשים ב- PCR.
לכימות יחסית, יש לכמת את ה- RNA לפני שעתוק הפוך, הנדרש גם בערכות שעתוק הפוכה רבות, למשל, לכמת את קלט ה- RNA כ 1 מיקרוגרם. מכיוון שה- cDNA המתועתק הפוך הוא פתרון מעורב, כולל RNA, oligo dT, אנזים, dNTP, ואפילו מעט שאריות DNA, תיגרם סטייה, כך שאי אפשר לכמת במדויק את ה- cDNA. לכן, יש צורך בכימות RNA. בהתחשב ביעילות השעתוק ההפוכה זהה בין דגימות שונות, כמות ה- cDNA המתקבלת צריכה להיות זהה, והניתוח הכמותי יכול להראות את השוואת רמות הביטוי של גנים שונים באותה כמות של ה- RNA הכולל. בעת ביצוע PCR כמותי של קרינה פלואורסצנטית, ייתכן שלא יידרש cDNA כמותי לאחר שעתוק הפוך מכיוון שניתן לפעול בגן הפניה הפנימי כהפניה.
הוא קשור בעיקר לגנים, ושעתוק הפוך של שבר ארוך אינו אפשרי עבור רוב הגנים. ראשית, היעילות של שעתוק הפוך נמוכה בהרבה מזו של PCR. שנית, האזור העשיר ב- GC והמבנה המשני של גנים רבים מגבילים הן את התעתיק ההפוך והן את ה- PCR. לבסוף, קשה להבטיח בו זמנית את הנאמנות ויעילות ההגברה של ה- PCR. בתהליך של שעתוק הפוך, אף אחד לא יכול להבטיח לקבל שבר ארוך עבור גנים עותקים נמוכים, במיוחד באמצעות oligo dT. באשר ל- 5 'UTR עם יותר GC, זה אפילו יותר קשה. לכן, זו עדיין שיטה סבירה להפוך תמלול עם פריימרים אקראיים, למצוא את אתרי המחשוף הטבעיים בשבר היעד, להגביר לפי קטעים ולאחר מכן לבצע את עיכול ההגבלה והקשירה. באופן כללי, קשה להגביר ישירות שברים הגדולים מ- 2 קילו־בייט, אך לא תמיד ניתן להשיג: 1. ראשית כל, להבטיח את תקינות ה- RNA/mRNA, וחילוץ TRIZOL עדיף. 2. ניתן להשתמש ישירות בערכת M-MLV RT-PCR. הארך את זמן החישול והגדל את מספר המחזוריות בתהליך ההגברה כראוי. לחלופין, ניתן ליישם PCR מקונן, או לבצע תגובה אחת או שתיים תחילה עם דנטורציה והארכת זמן מורחבים כראוי לפני הגברת PCR רגילה, מה שעשוי לסייע בהארכת שברים. שימו לב לנאמנות הפולימראז. 3. ניתן להשתמש ב- Taq Long ב- PCR כדי להשיג תוצאות אידיאליות. 4. ליישום ביטוי חלבון, יש ליישם פולימראז בנאמנות גבוהה.
ישנם שני סוגים של טרנסקריפטאז הפוך המוצעים על ידי TIANGEN: Quant/King RTase ו- TIANScript M-MLV. ההבדל העיקרי ביניהם הוא כמות הקלט של תבניות. קוואנט הוא טרנסקריפטאז הפוך ייחודי, השונה מ- M-MLV הנפוץ הנגזר מנגיף לוקמיה מאתר מולוני. קוואנט הוא טרנסקריפטאז הפוך חדש ביעילות גבוהה המתבטא באופן רקומביננטי על ידי הנדסת Escherichia coli. Quant מתאים להגברת 50 ng-2 מיקרוגרם של RNA עם פעילות תעתיק הפוך גבוהה ותשואה גבוהה. בהשוואה ל- MMLV או AMV רגילים, המאפיין הגדול ביותר של קוואנט הוא שיש לו זיקה חזקה מאוד לתבניות RNA ויכול להפוך את התבניות המורכבות של תמלול ללא דנטורציה בטמפרטורה גבוהה. לתבניות עם תוכן GC גבוה יותר, היעילות ההפוכה גבוהה יותר. עם זאת, לטרנסקריפטאז הפוך זה יש פעילות RNase H, שעשויה להשפיע על אורך המוצר cDNA (מתאים לתבניות <4.5 קב). עבור תמלול הפוך קונבנציונאלי, מומלץ לבצע תמלול הפוך TIANScript MMLV. RTase זה הוא אנזים שונה עם פעילות RNase H חלשה מאוד, המתאים לסינתזת cDNA ארוכה (> 5 kb).
תעתוק הפוך שלב אחד והגברת PCR הושלמו באותו צינור מבלי לפתוח את מכסה הצינור בין סינתזת cDNA והגברה, מה שעוזר להפחית את הזיהום. מכיוון שכל דגימות ה- cDNA המתקבלות משמשות להגברה, הרגישות גבוהה יותר, עם מינימום של 0.01 pg של סך ה- RNA. עבור RTPCR מוצלח של שלב אחד, פריימרים ספציפיים לגן משמשים בדרך כלל ליזום סינתזת cDNA. השיטה הדו-שלבית, כלומר תמלול הפוך והגברת PCR מתבצעת בשני שלבים. ראשית, שעתוק הפוך מתבצע מתבנית RNA להשגת cDNA, ו- cDNA המתקבל נתונה לתגובת PCR אחת או יותר. השיטה הדו-שלבית יכולה להשתמש באוליגו (dT) או בפריימרים אקראיים כדי להנחות את הסינתזה של הגדיל הראשון של cDNA, ויכולה להפוך את כל מידע ה- mRNA מהדגם הספציפי.
קטגוריות מוצרים
מדוע לבחור בנו
מאז הקמתו, המפעל שלנו מפתח מוצרים ברמה עולמית ראשונה תוך הקפדה על העיקרון
של איכות קודם כל. המוצרים שלנו צברו מוניטין מעולה בתעשייה ואמינות ערך בקרב לקוחות חדשים וישנים.








