2 × תערובת PCR של Taq Platinum
הגדרת פעילות
פעילות יחידה אחת (U) Taq פלטינה DNA פולימראז מוגדרת ככמות האנזים הנדרשת לשילוב של 10 nmol deoxynucleotides בחומרים בלתי מסיסים בחומצה בטמפרטורה של 74 מעלות צלזיוס תוך 30 דקות תוך שימוש ב- DNA זרע סלמון מופעל כתבנית/פריימר.
בקרת איכות
הטוהר על ידי זיהוי SDS-PAGE הוא יותר מ- 99%; לא זוהתה פעילות של נוקלאז אקסוגני; ניתן להעצים גן העתק יחיד בגנום האנושי; אין שינוי משמעותי בפעילות כאשר הוא מאוחסן בטמפרטורת החדר למשך שבוע.
פרמטרים טכניים עיקריים
יש לו פעילות אקסו-נוקלאז 5'-3 ופעילות אקס-נוקלאז 3'-5, ונאמנותו נמצאת לצד פולימראז Pfu. מהירות ההארכה של Taq Platinum Polymerase מהירה יותר מפולימראז Pfu ויעילות ההגברה גבוהה יותר. ניתן לחבר מוצרי PCR ישירות לקצה הבוטה או לשכפל עם וקטור TA. אם יש לשפר את יעילות השיבוט, מומלץ לטהר תחילה ולהוסיף תלות 3'-dA לפני השיבוט לתוך וקטור TA.
Taq Platinum MasterMix עם צינור אחד (אישור מוצר הייטק לאומי)
■ ה- Taq Platinum MasterMix שיפר את הספציפיות והרגישות של תגובת ה- PCR ויכול להגביר תבניות מורכבות עם תוכן GC גבוה, מבנה משני וכדומה. ניתן להעצים עד 2 עותקים של תבנית היעד, המבטיחה תוצאות ניסיוניות מדויקות יותר.
■ הנוסחה הייחודית של Taq Platinum MasterMix הופכת את כל מערכת התגובה ליציבה מאוד, והפעילות לא תושפע מהקפאה חוזרת ונשנית או מאחסון לטווח ארוך ב -4 מעלות צלזיוס.
■ הפתרון המעורב PCR היציב והיעיל שהוכן מראש יכול להפוך את הפעולה למהירה ופשוטה, ולהפחית מאוד את עוצמת העבודה וטעות הדגימה. משפר PCR וביצועי אופטימיזציה גבוהים כלולים גם הם בתמהיל, מה שמקטין את הדרישות לתנאי ה- PCR.
■ למוצר זה יש מערכות המכילות צבע וגם נטולות צבע. ניתן להעביר אלקטרופורזה ישירות מוצרי MasterMix המכילים צבע, ללא הוספת חיץ טעינה.
יישומים
הוא יכול להחליף פולימראז Pfu כדי להעצים מוצרי נאמנות מתבניות מורכבות כגון גנום, והוא מתאים ליישומים כגון שיבוט של גני ביטוי, מוטציות ספציפיות לאתר וניתוח של פולימורפיזם נוקלאוטיד יחיד (SNP) וכו '.
אמצעי זהירות בעיצוב פריימרים PCR:
אורך הפריימר הוא בדרך כלל 20-25 מר. עם זאת, בעת ביצוע PCR קטע ארוך, יש להגדיל את אורך הפריימר ל-30-35 מר.
■ אין זיווג משלים בין שני הפריימרים, במיוחד עבור 3 הבסיסים האחרונים בקצה 3 ′.
■ תכולת GC צריכה להיות 50-60%, ולהימנע מ- GC או AT עשירים מקומיים. על מנת להפוך את הפריימר והתבנית לאגד באופן יציב, הימנע ממבנה AT עשיר בקצה 3 ′.
■ הימנע מפריימר ליצירת מבנה משני.
■ בחר שני פריימרים עם טמפרטורות Tm קרובים זה לזה.
חישוב ערך Tm של פריימרים ל- PCR:
■ כאשר הפריימר פחות מ 20 מר: Tm = 2 ° C × (A+T)+4 ° C × (G+C).
■ כאשר הפריימר הוא יותר מ 20 מר: Tm = 81.5+0.41 × (GC%)-600/L, כאשר L הוא אורך הפריימר.
■ הגדר את טמפרטורת החישול ב (Tm-5) ° C.
קלט פריימר PCR
ניתן לבחור את הריכוז הסופי המתאים של פריימרים בין 0.1 מיקרומטר ל -1.0 מיקרומטר. ריכוז פריימר נמוך מדי מוביל לתשואה נמוכה של מוצרי הגברה, בעוד ריכוז פריימר גבוה מדי מועד יותר להגברה לא ספציפית. בדרך כלל, כאשר כמות ה- DNA של תבנית גדולה או מורכבת DNA תבנית (כגון DNA הגנום האנושי) כתבנית, ריכוז הפריימר צריך להיות נמוך יותר. כאשר כמות ה- DNA של תבנית קטנה או פשוטה של DNA תבנית (למשל, DNA פלסמיד וכו ') משמשת כתבנית, ריכוז הפריימר צריך להיות גבוה יותר.
ניתן להתאים את כל המוצרים עבור ODM/OEM. לפרטים,אנא לחץ על שירות מותאם אישית (ODM/OEM)
 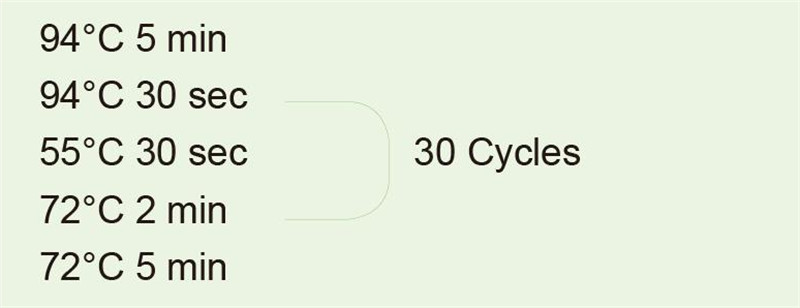 |
השתמש ב- DNA גנומי כתבנית להעצמת קטע של 1 ק"ג. לאחר תגובת ה- PCR, קח 5 μl לגילוי אלקטרופורזה. |
תבנית A-1
■ התבנית מכילה זיהומי חלבון או מעכבי טאק וכו '—— לטהר תבנית DNA, להסיר זיהומי חלבון או לחלץ DNA תבנית עם ערכות טיהור.
■ גילוי התבנית אינו שלם —— הגדילו את טמפרטורת הדנטורציה כראוי והאריכו את זמן ההפנמה.
■ התדרדרות התבנית —— הכינו מחדש את התבנית.
A-2 פריימר
■ איכות ירודה של פריימרים —— סינתזה מחדש של הפריימר.
■ הפחתת פריימר —— חלקו את הפריימרים בריכוז גבוה לנפח קטן לשימור. הימנע מהקפאה והפשרה מרובות או קריו-שימור לטווח ארוך של 4 מעלות צלזיוס.
■ תכנון לא נכון של פריימרים (למשל אורך פריימר לא מספיק, דימר נוצר בין פריימרים וכו ') -עיצוב פריימרים מחדש (הימנע מהיווצרות דימר פריימר ומבנה משני)
A-3 Mg2+ריכוז
■ מג2+ הריכוז נמוך מדי —— הגדל כראוי Mg2+ ריכוז: ייעל את ה- Mg2+ ריכוז על ידי סדרה של תגובות מ- 1 מ"מ עד 3 מ"מ עם מרווח של 0.5 מ"מ כדי לקבוע את ה- Mg האופטימלי2+ ריכוז לכל תבנית ופריימר.
A-4 טמפרטורת חישול
■ טמפרטורת החישול הגבוהה משפיעה על כריכת הפריימר והתבנית. —— הפחית את טמפרטורת החישול וייעל את המצב בשיפוע של 2 ° C.
זמן הארכה A-5
■ זמן הארכה קצר —— הגדל את זמן ההארכה.
תופעות: דגימות שליליות מציגות גם את להקות רצף היעד.
זיהום A-1 של PCR
■ זיהום צולב של רצף המטרה או מוצרי ההגברה —— בזהירות לא להעביר את המדגם המכיל את רצף המטרות בדגימה השלילית או לשפוך אותן מהצינור הצנטריפוגות. יש לבצע חיטוי של הריאגנטים או הציוד כדי לסלק חומצות גרעין קיימות, ולקבוע את קיומה של זיהום באמצעות ניסויי בקרה שליליים.
■ זיהום מגיב —— סלק את הריאגנטים ושמור בטמפרטורה נמוכה.
A-2 פרייםr
■ מג2+ הריכוז נמוך מדי —— הגדל כראוי Mg2+ ריכוז: ייעל את ה- Mg2+ ריכוז על ידי סדרה של תגובות מ- 1 מ"מ עד 3 מ"מ עם מרווח של 0.5 מ"מ כדי לקבוע את ה- Mg האופטימלי2+ ריכוז לכל תבנית ופריימר.
■ עיצוב פריימר לא תקין, ולרצף המטרה יש הומולוגיה עם רצף שאינו מטרה. —— פרימרים בעיצוב מחדש.
תופעות: להקות ההגברה PCR אינן תואמות את הגודל הצפוי, גדול או קטן, או שלפעמים מתרחשות גם להקות הגברה ספציפיות וגם להקות הגברה לא ספציפיות.
A-1 פריימר
■ סגוליות פריימר ירודה
—— פריימר בעיצוב מחדש.
■ ריכוז הפריימר גבוה מדי —— הגדל כראוי את טמפרטורת הדנטורציה והארך את זמן הדנטורציה.
A-2 Mg2+ ריכוז
■ ה- Mg2+ הריכוז גבוה מדי —— הפחת כראוי את ריכוז Mg2+: ייעל את ה- Mg2+ ריכוז על ידי סדרה של תגובות מ- 1 מ"מ עד 3 מ"מ עם מרווח של 0.5 מ"מ כדי לקבוע את ה- Mg האופטימלי2+ ריכוז לכל תבנית ופריימר.
A-3 פולימראז תרמו-יציב
■ כמות אנזים מוגזמת —— הפחיתו את כמות האנזים כראוי במרווחים של 0.5 U.
A-4 טמפרטורת חישול
■ טמפרטורת החישול נמוכה מדי —— הגדילו כראוי את טמפרטורת החישול או אמצו את שיטת החישול הדו-שלבית
A-5 מחזורי PCR
■ יותר מדי מחזורי PCR —— צמצם את מספר מחזורי ה- PCR.
A-1 פריימר—— ספציפיות ירודה —— עיצוב מחדש של הפריימר, שנה את המיקום והאורך של הפריימר כדי לשפר את הספציפיות שלו; או לבצע PCR מקונן.
A-2 תבנית DNA
—— התבנית אינה טהורה —— לטהר את התבנית או לחלץ DNA בעזרת ערכות טיהור.
A-3 Mg2+ ריכוז
—— מג2+ הריכוז גבוה מדי —— הפחת כראוי של Mg2+ ריכוז: ייעל את ה- Mg2+ ריכוז על ידי סדרה של תגובות מ- 1 מ"מ עד 3 מ"מ עם מרווח של 0.5 מ"מ כדי לקבוע את ה- Mg האופטימלי2+ ריכוז לכל תבנית ופריימר.
A-4 dNTP
—— ריכוז ה- dNTP גבוה מדי —— הפחית את ריכוז ה- dNTP כראוי
A-5 טמפרטורת חישול
—— טמפרטורת חישול נמוכה מדי —— הגדילו כראוי את טמפרטורת החישול
A-6 מחזורים
—— יותר מדי מחזורים —— אופטימיזציה של מספר המחזורים

השלב הראשון הוא לבחור את הפולימראז המתאים. פולימראז רגיל של Taq לא יכול לקרוא הגהה בגלל חוסר בפעילות אקסנוקלאז 3'-5 ', ואי התאמה תפחית מאוד את יעילות ההרחבה של שברים. לכן, פולימראז רגיל של Taq לא יכול להגביר ביעילות שברי מטרה הגדולים מ -5 קילו. יש לבחור Taq פולימראז עם שינוי מיוחד או פולימראז אחר באיכות גבוהה כדי לשפר את יעילות ההרחבה ולענות על הצרכים של הגברה של שברים ארוכים. בנוסף, הגברה של שברים ארוכים דורשת גם התאמה מקבילה של עיצוב הפריימר, זמן דנטורציה, זמן הארכה, pH מאגר וכו 'בדרך כלל, פריימרים עם 18-24 bp יכולים להוביל לתשואה טובה יותר. על מנת למנוע נזק לתבנית, יש להפחית את זמן הדנטורציה ב 94 ° C ל -30 שניות או פחות לכל מחזור, והזמן לעלות טמפרטורה ל 94 ° C לפני ההגברה צריך להיות פחות מדקה אחת. יתר על כן, הגדרת טמפרטורת ההרחבה על כ 68 ° C ועיצוב זמן ההארכה לפי הקצב של 1 קילו־בייט/דקה יכולים להבטיח הגברה יעילה של שברים ארוכים.
ניתן להפחית את שיעור השגיאות של הגברה PCR באמצעות פולימראזות שונות של DNA בנאמנות גבוהה. בין כל הפולימראזות של Taq DNA שנמצאו עד כה, לאנזים Pfu יש שיעור השגיאות הנמוך ביותר והנאמנות הגבוהה ביותר (ראו טבלה מצורפת). בנוסף לבחירת האנזים, חוקרים יכולים להפחית עוד יותר את שיעור המוטציות של ה- PCR על ידי ייעול תנאי התגובה, כולל ייעול הרכב החיץ, ריכוז פולימראז יציב ואופטימיזציה של מספר מחזור ה- PCR.
קטגוריות מוצרים
מדוע לבחור בנו
מאז הקמתו, המפעל שלנו מפתח מוצרים ברמה עולמית ראשונה תוך הקפדה על העיקרון
של איכות קודם כל. המוצרים שלנו צברו מוניטין מעולה בתעשייה ואמינות ערך בקרב לקוחות חדשים וישנים.








